|
APLICACIÓN DE LEVADURAS NO CONVENCIONALES EN ENOLOGÍA. CULTIVOS SECUENCIALES DE METSCHNIKOWIA PULCHERRIMA / SACCHAROMYCES CEREVISIAE
M. Angelica Ganga,1 , Alvaro Aravena,1 Hector Rebolledo,1 Felipe Fonseca,1
Edith Quezada,1 Claudio Martínez,1,2 Pedro Carriles,3 José María Heras4 Anne Ortiz-Julien5
1Departamento en Ciencia y Tecnología de los Alimentos. Laboratorio de Biotecnología y Microbiología Aplicada (LAMAP). Universidad de Santiago de
Chile. 2Centro de Estudios en Ciencia y Tecnología de los Alimentos. Universidad de Santiago de Chile. 3Lallemand Chile.4 Lallemand Península Ibérica.
5 Lallemand SAS, Blagnac, Francia.
INTRODUCCIÓN
En la producción del vino las levaduras son responsables de transformar el azúcar presente en el mosto de uva en etanol, dióxido de carbono y cientos de productos secundarios, que colectivamente, contribuyen a las cualidades propias del producto (Fleet, 2003). Por ello, estos microorganismos pueden influir positiva o negativamente en las cualidades sensoriales del vino. Inicialmente, el mosto es predominado por levaduras no Saccharomyces, existiendo una baja concentración de levaduras del género Saccharomyces, sin embargo, estas últimas poco a poco van predominando en el proceso fermentativo (Pretorius et al 2000). Si bien es cierto las levaduras no Saccharomyces durante mucho tiempo fueron consideradas como perjudiciales para las características organolépticas en el vino, en los últimos años se ha evidenciado que al usar cultivos iniciadores de estas levaduras y bajo condiciones controladas pueden otorgar características organolépticas más complejas aumentando así la calidad final del producto (Ciani y Ferraro, 1998; García et al. , 2002). Ciani y Picciotti (1995) al realizar experimentos en mostos blancos y solo utilizando de manera independiente 6 levaduras no Saccharomyces, mostraron que la fermentación de mosto natural con Candida stellata entregó un producto con mayor concentración de glicerol al comparar ésta con el resto de microorganismos usados, incluyendo S. cerevisiae. Por otra parte, las especies Hansianospora uvaum y Kloeckera apiculata ensayadas, mostraron valores muy similares a lo obtenido en la fermentación solo con S. cerevisiae, pero además el cultivo mixto produjo altas cantidades de etil acetato y ácido acético, lo cual las excluiría para su uso en vinificación. Ciani y Maccarelli (1998) al realizar un experimento similar, observaron que en el caso del uso de C. stellata, el producto obtenido mostró una alta concentración de glicerol y ácido succínico en comparación con las otras especies ensayadas. Por su parte, Garcia et al. (2010) al realizar ensayos con Candida membranifaciens en mosto variedad Chardonnay obtuvo vinos más complejos organolépticamente con un aumento especialmente de esteres.
Nuestro grupo de trabajo lleva algunos años trabajando en definir la potencialidad de levaduras no Saccharomyces para su uso en enología mediante el estudio de las enzimas que éstas secretan al medio (xilanasas, celulasas glicosilasas, entre otras) (Ganga y Martinez, 2004). Por esto, se ha logrado definir que una cepa de Metchiniscowia pulcherrima, aislada desde la zona del Maule de Chile (entre los paralelos 35° y 36° latitud sur) secreta una enzima con actividad α-arabinofuranosidasa al medio de cultivo.
¿Por qué la importancia de una enzima con actividad α-arabinofuranosidasa en enología?
Uno de los factores que más influyen en el aroma característico de una variedad de uva es su etapa de maduración. Tanto compuestos libres como ligados se acumulan en la uva durante este periodo (Gunata et al. 1985; Sánchez et al. 2007). Existen muchos compuestos aromáticos que se encuentran presentes en la uva, entre los cuales se destacan alcoholes, aldehídos, cetonas, ésteres, ácidos y terpenos (Aznar et al. 2001). Sin embargo, los terpenos son los principales componentes responsables del aroma característico de los frutos ( Vilanova y Sieiro, 2006 ). Una considerable parte de éstos se encuentran en forma ligada a azucares impidiéndoles que formen parte del aroma del producto (Günata et al. 1988). Estos terpenos glicosilados pueden ser transformados a su forma libre por la acción hidrolítica de enzimas glicosídicas (figura 1) (Gunata et al. 1988). Los terpenos más destacados son: linalool, geraniol, nerol, citronerol y α-terpineol (Marais, 1983; Günata et al. 1985). La mayor parte de los residuos glicosídicos que acompañan a los precursores aromáticos son del tipo arabinofuranosidos y glicosidos (Yanai y Sato, 2000), es por esto que las enzimas con actividad α-arabinofuranosidasa y ß-glucosidasa cobran gran importancia en la liberación de compuestos aromáticos volátiles. Como se aprecia en la figura 1, la primera enzima cataliza la hidrólisis del enlace entre la arabinosa y la glucosa, liberando el sustrato para la acción de la segunda enzima, la cual es capaz de hidrolizar la unión entre la glucosa y el terpeno, pasando este último a formar parte del aroma (Günata et al. 1988).
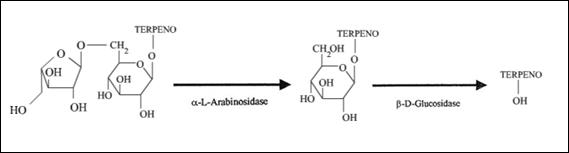
Figura 1: Acción secuencial de enzimas hidrolíticas sobre precursores aromáticos (Gunata et al, 1998)
Basados en lo anteriormente expuesto, el objetivo del presente trabajo fue determinar si el proceso de secado de la levadura M. pulcherrima L1781 afectó en la producción de la actividad α-arabinofuranosidasa descrita en el aislado original, asi como estudiar el efecto de su uso en cultivos secuenciales (M. pulcherrima + S cerevisiae) sobre las caracteristicas organolépticas de los vinos producidos.
MATERIAL Y MÉTODOS
Estudios preliminares
Microorganismos: Para el estudio se utilizó la cepa M. pulcherrima L-1781(perteneciente al cepario Laboratorio de Biotecnología y Microbiología Aplicada de la Universidad de Santiago de Chile (LAMAP-USACH), producida en forma seca activa por la empresa Lallemand (nombre comercial Flavia®). Se utilizó además la levadura Saccharomyces cerevisiae var. bayannus Lalvin QA23® (Lallemand).
Para la inoculación de los microorganismos en forma seca activa entregados por Lallemand se siguió el protocolo indicado en cada envase. Se utilizó una concentración de 25 g/HL en los ensayos realizados.
Análisis RAPD: Para la reacción RAPD se utilizó la siguiente mezcla: dNTPs 5 µL (1mM) ; MgCl2 4 µL (25mM); Taq 2 µL (1U/ µL); Primer (5`-CTGAAGCGCA-3`)16 µL (10 µM) y DNA 2 µL (~0,5 µg/ µL), llevando todo a un volumen final de 50 µL con agua destilada. El programa de amplificación fue: 95 ºC 3 min , 94 ºC 1 min, 35 ºC 2 min , 72 ºC 2 min con 44 ciclos. Posteriormente un ciclo de 72 ºC 5 min.
Crecimiento en medio con coseta de remolacha: Con el fin definir la actividad α-arabinofuranosidasa de los aislados de levaduras en estudio (levadura seca M. pulcherrima L1781, así como la cepa origina (cepa control que fue obtenida directamente del cepario LAMAP-USACH) cada levadura fue crecidas en medio de cultivo con coseta de remolacha (3 g/L (NH4) 2 SO4, 1 g/L KH2 P04, 0,5 g/L MgSO4 x 7 H2O, 20 g/L coseta de remolacha, 5 g/L de extracto de levadura, ajustado a pH 5,2) (Labbé y Pérez, 2003; De Ioannes et al. 2000).
Cuantificación de la actividad a -arabinofuranosidasa: Una vez crecido el microorganismo en el medio inductor de la actividad buscada, 10 mL de medio de cultivo se concentró a sequedad mediante liofilización. La cantidad de proteína presente en el extracto seco se obtuvo por el protocolo descrito por Bradford (1976), utilizando albúmina de suero bovina (BioLabs, New England) como estándar. Con las muestras liofilizadas se determinó la actividad enzimática de acuerdo al protocolo descrito por Gunata et al. (1990). Una unidad (U) de actividad enzimática fue definida como la cantidad de enzima que consume 11 µmol de pNPA por minuto.
Fermentación y análisis
Fermentaciones en mosto natural: Se llevaron a cabo fermentaciones a nivel de laboratorio y nivel piloto. En ambos casos se ensayaron con cultivo secuencial M. pulcherrima L1781/ S. cerevisiae Lalvin QA23® y como ensayo control se uso una fermentación con solo S. cerevisiae Lalvin QA23®. En las fermentaciones se utilizaron los nutrientes GoFerm Protect® (Lallemand) y Fermaid®K (Lallemand) de acuerdo a las instrucciones del proveedor. Al finalizar las fermentaciones se dejaron en reposo los vinos por 21 días a 12 ºC, agregando enzimas Lallzyme®Beta (Lallemand) a una concentración de 5 g/HL.
Ensayos a nivel de laboratorio: Se fermentó 3,2 L de mosto natural variedad Moscatel de Alejandría (Chile), contenidos en reactores con capacidad máxima de 5 L. Para la inoculación de las levaduras en estado seco de S. cerevisiae Lalvin QA23® y M. pulcherrima L1781 se realizaron cultivos iniciadores (pie de cuba) con una concentración de 100 g/L. Una vez obtenido el pie de cuba de cada levadura, en el caso de la levadura M. pulcherrima se inoculó cada mosto a una concentración de 1x107 ufc/mL. Luego de 48 horas se agregó al mosto una concentración de 1x108 ufc/mL de S. cerevisiae. Para determinar la viabilidad de M. pulcherrima se tomaron muestras del mosto cada 6 horas los dos primeros días y luego cada 24 horas hasta su desaparición, mientras que para la cuantificación de S. cerevisiae las muestras fueron recolectadas cada 48 horas. Como ensayo control se realizó una fermentación usando un monocultivo (solo S. cerevisiae) a una concentración de 1x108 ufc/mL. Los procesos fermentativos se siguieron mediante la cuantificación de azúcares reductores (Somogyi, 1952), tomando muestras cada 2 días hasta el final de la fermentación. Los ensayos fueron realizados por triplicado.
Ensayos a nivel piloto: Los ensayos se realizaron en una empresa vitivinícola de Chile. Para ello, se inocularon 900 L de Moscatel de Alejandría a una concentración de 25 g/hL de levadura seca de M. pulcherrima (Lallemand Inc). Luego de 48 horas de incubación se inoculó con S. cerevisiae Lalvin QA23® a una concentración de 25 g/hL. La fermentación fue seguida mediante la disminución de la densidad. Como ensayo control se realizó una fermentación utilizando solo S. cerevisaie.
Análisis fisicoquímicos, sensorial y perfil aromático de los vinos: Finalizado el tiempo de maceración con lias, los vinos se filtraron y se les realizó los análisis fisicoquímicos (concentración de azucares reductores, concentración de alcohol, pH, acidez libre y total) mediante los protocolos indicados por la OIV (Bordeau and Scarpa, 1998). Los análisis fueron hechos por duplicados. Además los vinos fueron evaluados por un panel de enólogos (Flanzy, 2003; Anzaldúa-Morales, 1994) .
El perfil aromático de los vinos fue realizado por el Centro de Aromas de la Pontificia Universidad Católica de Chile, usando GC-MS (HP6890, MSHP972; Heweltt-Packard, Palo Alto CA).
Análisis estadístico:Todos los resultados obtenidos fueron analizados a través de un análisis de varianza (ANOVA), haciendo uso del programa computacional Statgraphic Centurion XVI versión 15.2.05.
RESULTADOS Y DISCUSIÓN
Estudios preliminares
Comparación del aislado LAMAP-USACH M. pulcherrima L1781 y el producto seco obtenido por Lallemand
Con el fin de comprobar que el aislado seco obtenidos por la empresa Lallemand era el caracterizado por LAMAP – USACH (Fonseca, 2008) se llevó a cabo un análisis molecular para comprar los perfiles genéticos de ambos aislados. Ensayos previos habían determinado que utilizando el partidor descrito en Materiales y Métodos, permite diferenciar entre distintas cepas de M. pulcherrima . Basado en ello, el DNA de cada muestra (levadura seca de Lallemand y la obtenida directamente del cepario LAMAP-USCH) fue sometido a un análisis de RAPD (Random Amplified Polymorphic), figura 2. En esta figura se puede observar que ambos aislados muestras un mismo patrón electroforético, lo cual confirma que se trataría del mismo aislados en ambos casos.
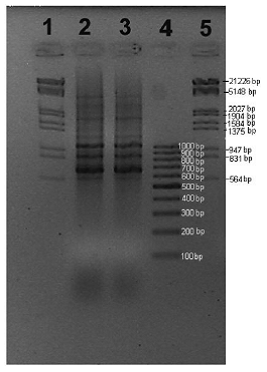
Figura 2: Electroforesis en gel de agarosa 1%. Carril 1 y 5: marcador fago ? digerido con Eco RI+ Hin dlll; Carril 2: aislado de Metschnikowia pulcherrima L1781 de LAMAP; Carril 3: Metschnikowia pulcherrima L1781 seco entregada por Lallemand; Cariil 4: marcador 100 pb.
Cuantificación de la actividad α-arabinofurnosidasa en el aislado LAMAP-USACH L1781
Con el fin de determinar si el proceso de secado de la levadura M. pulcherrima L1781 afecto en la secreción de la actividad α-arabinofuranosidasa se llevaron a cabo ensayos con el aislado seco y el aislado control (cepario LAMAP-USACH). Para ello, ambas levaduras fueron crecidas en un medio con coseta de remolacha como fuente de carbono, con el fin de inducir la actividad enzimática. La tabla 1 muestra los resultados obtenidos.
Tabla 1: Determinación de la actividad α-L-arabinofuranosidasa

Nota: La coincidencia de una o más letras entre los valores de una misma columna indica que no existen diferencias estadísticamente significativas a un nivel de confianza del 95%. El crecimiento de las levaduras se realizó por duplicado. La actividad enzimática de cada muestra fue determinada por triplicado. U: cantidad de enzima que consume 1 µmol de pNPA por minuto.
Al contrastar las actividades obtenidas de ambos aislados es posible observar que no existen diferencias estadísticamente significativas entre la actividad del aislado seco con el microorganismo original. Por lo cual la producción de actividad α-arabinofuranosidasa por parte del M. pulcherrima seca no se vio afectada por el proceso de secado.
Vinificación en mosto natural
Ensayo a nivel de laboratorio: Los ensayos fueron realizados en mosto de la variedad Moscatel de Alejandría como se indicó en Materiales y Métodos. Esta variedad ha sido descrita como una de las más ricas en compuestos y precursores aromáticos, específicamente monoterpenos, ya sea en su forma libre (1513 µg/L) como también ligada a glicósidos (4040 µg/L) (Ribérau-Gayon et al. 2000). Un primer ensayo fue realizado consistente en fermentaciones con cultivos secuenciales de levadura M. pulcherrima L-1781 y luego S. cerevisaie. El aislado no Saccharomyces se dejó incubando por 48 horas para luego agregar S. cerevisiae Lalvin QA23®. Paralelamente se llevó a cabo un segundo ensayo en donde solo se utilizó S. cerevisiae (monocultivo). La fermentación alcohólica fue seguida mediante la cuantificación de azúcares reductores y adicionalmente se determinó la viabilidad de las levaduras a lo largo del proceso.
Crecimiento de los microorganismos: Para verificar que la levadura M. pulcherrima creció en el mosto inoculado, se tomaron muestras cada 6 horas durante un periodo de 2 días, las cuales fueron inoculadas en placas con medio de cultivo. La levadura M. pulcherrima presenta la capacidad de producir un pigmento rojizo en el medio de cultivo, resultando en un halo rosado alrededor de las colonias. Esto facilita entonces su diferenciación (Sipiczki, 2006). Los resultados mostraron que M. pulcherrima logró permanecer en el mosto durante las 48 horas de incubación. La población de levaduras se mantuvo prácticamente constante, no observando un crecimiento mayor. Luego de inoculado el mosto con S. cerevsiaie, la población de la levadura rosada desapareció, predominado íntegramente levaduras S. cerevisaie (colonias blancas). Se conoce que S. cerevisiae es una levadura altamente fermentadora (Moreno y Polo, 2005), lo cual hace suponer que una vez inoculada la producción de alcohol aumentó rápidamente, produciendo así la muerte de las levaduras menos tolerantes al alcohol. Se ha descrito que M. pulcherrima lograría permanece en un medio de cultivo hasta con un 6% v/v de etanol (Parapouli et al. 2010). Desde un punto de vista enológico, esto es de suma importancia, pues permitiría estar seguros que luego que se ha inoculado el mosto con S. cerevisiae, M. pulcherrima desaparecería, no transformándose en una levadura problema en el proceso productivo.
Seguimiento de la fermentación: El seguimiento de los procesos fermentativos ensayados (cultivos secuencial y monocultivo) fue llevado a cabo mediante el consumo de azucares reductores. E l consumo de azúcar se inicio lentamente en el cultivo secuencial manteniéndose prácticamente constante los niveles de azúcar hasta el tercer día. Esto coincide con que M. pulcherrima se mantuvo las primeras 48 horas antes de añadir el cultivo de S. cerevisaie. Es sabido que M. pulcherrima tiene un bajo poder fermentativo (Ciani y Maccarelli, 1998) y por ende una baja tasa de consumo de glucosa/fructosa en condiciones anaerobias. Sin embargo, luego de la inoculación de S. cerevisiae se observó un abrupto descenso en los niveles de azúcar, siendo consumida rápidamente. Este comportamiento se mantuvo aproximadamente hasta el décimo día, ya que de ahí en adelante el consumo de azúcar se hizo más lento y paulatino. Esta disminución puede ser explicada por el aumento de la concentración de etanol en el medio, el cual deja a gran parte de las levaduras metabólicamente inactivas, pudiendo afectar el metabolismo de la glucosa (Holm et al. 2001). En el caso, de la fermentación control (monocultivo S. cerevisiae) se obtuvo un consumo rápido de los azucares desde el inicio de la fermentación hasta aproximadamente el octavo día, para luego mostrar un comportamiento lento de la disminución de azucares reductores, similar a lo observado en el cultivo secuencial.
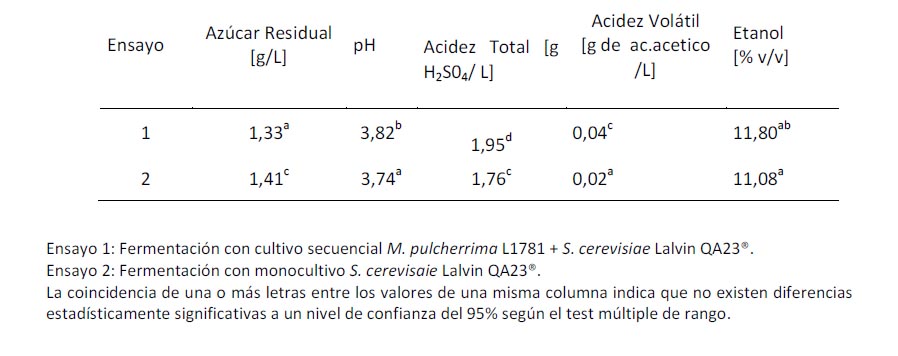
Análisis fisicoquímico de los vinos: Una vez terminada la fermentación alcohólica y luego de agregado el preparado enzimático, los vinos fueron dejados en reposo por 21 días a 12 ºC. Luego de dicho periodo se llevo a cabo los análisis fisicoquímicos a los vinos. La tabla 2 muestra estos resultados.
Para analizar concentración de etanol se hizo el test de caja y bigotes, debido a que los datos no mostraron una distribución normal.
En la tabla es posible observar que para todos los ensayos los valores de concentración de pH, etanol y acidez volátil se encuentran dentro de los valores típicos de los vinos (Bordeu y Scarpa, 2000). En relación con el azúcar residual se observa una menor cantidad en el ensayo realizados con cultivos secuenciales que en el monocultivo. Similar resultados fue obtenido Jolly et al. (2003) al usar cultivos mixtos no Saccharomyces /S. cerevsiae. A pesar de ello, ambos vinos desde un punto de vista enológico lograron fermentaciones exitosas (vinos secos).
Tabla 2: Análisis fisicoquímicos a los vinos de variedad Moscatel de Alejandria utilizando cultivos secuencial o monocultivos
Análisis aromático de los vinos: Para conocer las características aromáticos de los vinos obtenidos, éstos fueron sometidos a un panel de cata. El panel de degustación entregó la mejor puntuación al vino obtenido con el cultivo secuencial (M. pulcherrima + S. cerevisiae). Los enólogos lo describieron como un vino con aromas más intensos, destacándose afrutados, florales y a ésteres. Como se indicó anteriormente, la levadura M. pulcherrima durante su permanencia en el mosto secretaria al medio una enzima que tendría actividad α-arabinofuranosidasa. Esta enzima actuaria sobre los terpenos glicosilados encontrados en el mosto (Gunata et al., 1998).
Posteriormente, con la ayuda de una enzima ß-glucosidasa (en este ensayo entregada por producto Lallzyme®Beta), permitiría que estos terpenos formarán parte de la fracción aromática del vino. La presencia de terpenos libres otorgan a los vinos marcados aromas florales (geraniol y linalol) y cítricos (citronerol) (Günata et al. 1985; Marais, 1983; Vilanova y Sieirio, 2006).
Caracterización de Metschnikowia pulcherrima 346 en condiciones enológicas con inoculación secuencial
Para caracterizar la capacidad fermentativa de M. pulcherrima (referencia comercial Flavia®) en condiciones enológicas, se llevaron a cabo una serie de fermentaciones en mosto sintético en primer lugar y posteriormente validadas en mosto de Sauvignon Blanc.
Las pruebas en mosto sintético mostraron la buena multiplicación de la M.pulcherrima durante los dos primeros días de FA. Una vez el medio es inoculado con S.cerevisiae se observa una etapa de cohabitación de ambas especias antes de un drástico declive de M. pulcherrima, permitiendo una completa colonización del medio por S. cerevisiae.
Tras estos estudios en mostos sintético validando las interacciones y dinámicas poblacionales de las dos especies, en las experiencias llevadas a cabo en mosto de Sauvignon Blanc, la inoculación de S.cerevisiae se llevó a cabo 24 horas después de la inoculación con Flavia®. Hay que tener en cuenta la elevada sensibilidad al SO2 de M. pulcherrima por lo que es necesario limitar los niveles en el mosto de partida previo a la inoculación (figura 3).
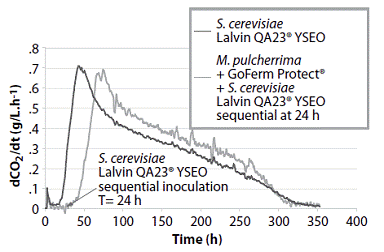
Figura 3: Cinéticas de fermentación de Metschnikowia pulcherrima y Saccharomyces cerevisiae comparada con S. cerevisiae sola en Sauvignon Blanc fermentado a 18 ºC
Entre los años 2010 a 2012 se han realizado fermentaciones en condiciones reales de bodega en varios países vitivinícolas (Chile, Francia, Portugal, Italia, España) utilizando M. pulcerrima L1781 seca (Flavia®). En estos casos se utilizaron varietales de uva: Sauvignon Blanc, Albariño, Garganega o Colomard, evidenciando resultados comunes, es decir, mayor complejidad en el aroma de los vinos fermentados con los cultivos secuenciales, siendo destacados los aromas relacionado con terpenos y tioles.
Una de estas experiencias durante la vendimia 2011, se realizó con uvas de la variedad Alvarinho de la AOC Vinho Verde (Portugal) en una bodega de la subregión de Vale do Ave. Tras las operaciones prefermentativas, el mosto se dividió de manera homogénea. En uno de los depósitos se inoculó con una levadura Saccharomyces cerevisiae (SC1) utilizada habitualmente en la bodega a una dosis de 25 g/hL, y en otro se realizó la inoculación secuencial con M. pulcherrima L1781 (Flavia®) y Saccharomyces cerevisiae complementaria Lalvin QA23® (Flavia® +SC2) a las 24 horas de la inoculación de M. pulcherrima. Ambas levaduras se inocularon a la dosis de 25 g/hL. Una vez finalizadas las fermentaciones, los vinos fueron embotellados y se realizaron análisis de compuestos varietales aromáticos por cromatografía de gases/espectrometría de masas. Los resultados mostraron una mayor concentración en terpenos característicos de esta variedad, como linalol, terpineol o ß-damascenona. Al mismo tiempo se realizó un análisis sensorial mediante sistema normalizado ISO 11035 con la utilización de descriptores consensuados y cuantificables con la participación de 5 catadores cualificados y entrenados previamente al método y a los vinos a catar. Los resultados se muestran en la figura 4. El vino con inoculación secuencial se relacionó en cata con descriptores varietales (floral, plantas aromáticas, cítricos) en concordancia con mayores niveles de estos compuestos, y una mejor percepción de volumen, equilibrio y longitud en boca.
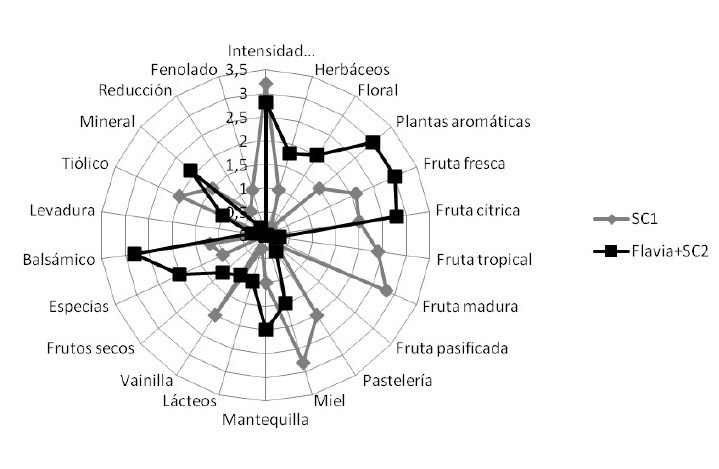
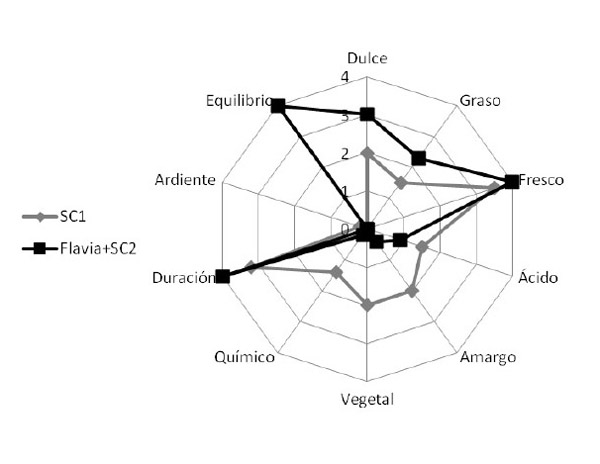
Figura 4. Representación de las variables (descriptores consensuados) y observaciones (muestras de vinos) en las fases olfativa (arriba) y gustativa (abajo)
CONCLUSIONES
Este estudio demostró las potencialidades que tienen las levadura no Saccharomyces en el campo de la enología. Si bien se conoce que la presencia de éstas al inicio de la fermentación resulta en aromas más complejos en el producto final, a nivel enológico resulta difícil su uso debido a la falta de control. Mediante el uso de cultivo puros y que puedan ser controlados mediante un proceso natural de biocontrol, como sería la producción de etanol por parte de S. cerevisaie, permitiría que estas levaduras fueran usadas sin restricciones en la bodega.
El uso de M. pulcherrima L1781 en forma seca activa (Flavia®) en fermentaciones secuenciales ha mostrado la producción de vinos organolépticamente más complejos. Esta levadura actúa en una primera parte sobre los terpenos glicosilados presentes de manera natural en la uva, además de ser capaz de liberar tioles volátiles durante su permanencia en el mosto. Ambos compuestos volátiles entregan aromas afrutados y complejos, una cualidad buscada por los consumidores más exigentes.
Bibliografía
AnzaldúaMorales, A. La evaluación sensorial de los alimentos en la teoría y la práctica. Edit. Acribia, Zaragoza, España. 1994.
Aznar, M., Lopez, R., Cacho, J., Ferreira, V. Identification and quantification of impact odorants of aged red wines from Rioja. GC-Olfactometry, quantitative GC–MS, and odor evaluation of HPLC fractions. J. Agric. Food Chem. 2001; 49: 2924–2929.
Bordeu E, Scarpa J. En: Ediciones Universidad Católica de Chile, Textos Universitarios Facultad de Agronomía e Ingeniería Forestal. Análisis químico del vino. Santiago, Chile, 1998.
Bradford, M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Bioch. 1976; 72: 248-254.
Ciani M, Ferrano L. Combined use of immobilized Candida stellata cells and Saccharomyces cerevis aie to improve the quality of wines. J Appl Microbiol 1998; 85: 247-54.
Ciani M, Picciotti G. The growth kinetics and fermentation behaviour of some non Saccharomcyes yeast associated with wine making. Biotechnol Lett 1995; 17: 1247-50.
Ciani, M., Maccarelli, F. Oenological properties of non Saccharomyces yeasts associated with wine – making. Worl J Microbiol Biotech1998; 14: 199-2003.
Flanzy, C. López, A. Quevedo, J. Madrid, V. Madrid, A. Enología: Fundamentos científicos y tecnológicos. Mundi-Prensa Libros. Madrid. 2003
Fonseca, F. (2008) Estudio de la producción de enzimas glicosídicas en levaduras vínicas nativas y su potencial uso en la industria. Trabajo de tesis para optar al título de Ingeniero en Alimentos. Facultad Tecnológica. Universidad de Santiago de Chile.
Ganga, M.A y Martínez, C. Effect of wine yeast monoculture practice on the biodiversity of non- Saccharomyces yeasts. J Appl Microbiol 2004; 96: 76 - 83
Garcia A, Carcel C, Dulau L, Samson A, Aguera E, Agosin E. Influence of a mixture culture with Debaryomyces vanriji and Saccharomcyes cerevisiae on the volatiles of a muscat wine. J Food Sc2002; 67: 1138-43.
García, V. Vasquez, H., Fonseca, F., Manzanares, P., Viana, F., Martínez, C. y Ganga, M.A. Effect of the use of mixed wine yeasts cultures in the production of Chardonnay wines. Rev Argen Microbiol 2010; 42: 226-229.
Günata, Y.Z., Bitteur, S., Brillouet, J.M., Bayonove, C.L., Cordonnier, R.. Sequential enzymatic hydrolysis of potentially aromatic glycosides from grapes. Carbohydrate Research 1988; 184: 139–149.
Günata, Z., Bayonove, C., Baumes, R., Cordonnier, R. (1985) Aroma of grapes. I. Extraction and determination of free and glycosidically bound fraction of some white grape varieties. J Chromatogr1985; 331: 83–90.
Gunata, Z., Brillouet, J. M., Voirin, S., Baumes, R., Cordonier, R. Purification and some properties of an ? -L-Arabinofuranosidase from Aspergillus niger . Action on grape monoterpenyl arabinofuranosylglucosides. J Agricul Food Chem 1990, 38: 772-776.
Holm, E., Nissen, P. Sommer, P. Nielsen, J., Arneborg, N. The effect of oxygen on the survival of non- Saccharomyces yeasts during mixed culture fermentations of grape juice with Saccharomyces cerevisiae. J Appl Microbiol 2001; 91: 541-547.
Jacksson, R. Wine Science. Academic Press. USA. 1994.
Marais, J. Terpenes in the aroma of grapes and wines: a review. South Afr J Enol Viticul 1983; 4: 49-58.
Moreno, V., Polo, M. Winemaking Biochemistry and Microbilogy: Current Knowledge and Future Trends. Critic. Reviews Food Sc Nutrit 2005; 45.
Parapouli, M., Hatziloukas, E., Drainas, C., Perisynakis, A. The effect of Debina grapevine indigenous yeast strains of Metschnikowia and Saccharomyces on wine flavor. J Ind Microbiol Biotechnol 2010; 37:85-93
Pretoius, I. Tailoring wine yeast for the new millennium: novel approaches to the ancient art of winemaking. Yeast 2000; 16: 675-729
Ribereau-Gayon, P., Glories, Y., Maujean, A., Dubourdieu, D. Varietal Aroma. Handbook of Enology The Chemistry of wine stabilization and treatments (2). Chichester, UK: John Wiley and Sons, Ltd. 2000.
Sánchez, E., Díaz-Maroto, M., González, M., Soriano-Pérez, A., Pérez-Coello, M. Aroma profile of wines from Albillo and Muscat grape varieties at different stages of ripening. Food Control 2007; 18: 5398-403.
Somogyi, M. Notes of Sugar Determination. J Biol Chem 1952; 195: 19-23.
Vilanova, M. and Sieiro, C. Determination of free and bound terpene compounds in Albariño wine. J Food Compos Anal 2006; 19: 694-697.
Yanai, T., Sato, M. Purification and Characterization of a Novel a.-L-arabinofuranosidase from Pichia capsulata X91. Bioscience, Biotechnology and Biochemistry 2000; 64: 1181-1188.
(Agosto 2013)
|